KAIST는 교내 생명과학과 김윤기 교수 연구팀이 진핵세포 안에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
KAIST에 따르면 현재 일반적으로 사용되는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가져 세포 안에서 매우 불안정한 특징을 보인다.
반면 원형의 RNA(circular RNA)는 선형 RNA보다 매우 안정된 상태로, 다수 국내외 제약회사에서는 RNA안정성을 높이기 위해 원형의 RNA를 개발하는 상황이다. 같은 이유로 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 대해 관심이 쏠린다.
선형 mRNA는 세포 내에서 매우 불안정하기 때문에 항체 생성 효율을 높이기 위해서는 고용량의 mRNA 접종이 불가피하다. 반면 고용량 접종은 mRNA에 기인하는 부작용을 초래하는 문제를 드러낸다.
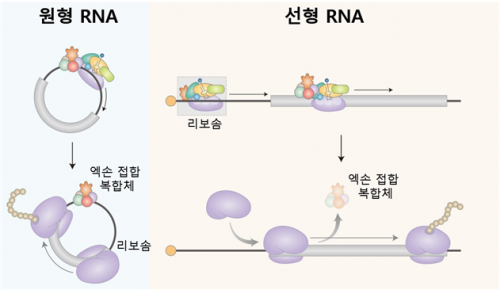
이와 관련해 연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명해 주목받는다. 세포 안에서 생성되는 대부분의 원형 RNA가 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있다는 것이 이번 규명의 핵심이다.
엑손 접합 복합체가 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합해 최종적으로 리보솜을 끌어와 단백질 합성을 유도한다는 것이 밝혀진 것이다.
이는 기존에 알려지지 않았던 엑손 접합 복합체와 eIF3 복합체의 결합을 처음으로 제시하면서, 엑손 접합 복합체에 의한 캡-비의존적 단백질 번역을 밝혔다는 점에서 의미를 갖는다.
특히 제시된 엑손 접합 복합체에 의한 캡-비의존적 단백질 번역은 기존의 전통적 선형 mRNA 기반 치료제 외의 circular RNA를 포함한 캡 구조를 지니고 있지 않은 형태의 RNA에서 단백질 번역을 일으킬 수 있다는 강점이 있다.
전통적 mRNA 기반 치료제와 비교해 높은 안정성을 확보하는 동시에 단백질 번역 효율이 떨어지는 circRNA의 한계를 극복할 새로운 단백질 번역 기전을 밝혀, circRNA 기반 치료제의 효율과 활용을 확대할 수 있게 한 점도 연구팀의 성과다.
KAIST 생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1저자로 참여한 이번 연구는 한국연구재단의 지원을 받아 수행됐으며, 최근 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에도 소개됐다.
김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 것에 의의가 있다”며 “이 작용과정을 이용해 부작용을 최소화하고, 고안정성·고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대한다”고 설명했다.
































